图 1:电子轨道
现在要把电子放到这些轨道上面来,使电子的总能量最小. 这种状态叫做原子的基态. 理想的状态是,所有电子都在最小的一圈轨道上,但是由于每条轨道只能容纳一定数目的电子,另一些电子不得不进入其他轨道.
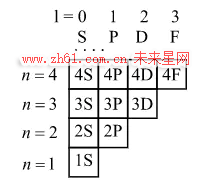
为了解释每条轨道能容纳多少电子,把每个轨道的 “空位” 用一行格子描述. 当一行格子被电子填满时,该轨道就不能容纳更多电子了.
图 2:用格子描述电子轨道
给不同的格子命名: 从半径最小的轨道开始,用数字 1,2,3 等依次命名每条轨道,这些数字也叫主量子数,用 n 来表示. 在上图中,每条轨道从第一列开始依次用 S,P,D,F... 命名,每一列有相同的角量子数,用 l 来表示. S,P,D,F\dots 的角量子数依次是 l = 0,1,2,3\dots. 把行标和列标组合起来, 就能得到任意一个格子的名称,例如第三行第二列的格子叫做 3P. 对于主量子数为 n 的行,角量子数从 0 增加到 n-1,也就是说第 n 行有 n 个格子.
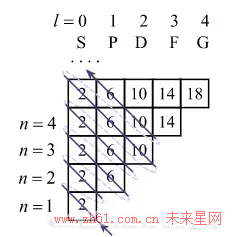
接下来,每个格子又能装不同数目的电子,任意一格能装的电子数等于 2(2l + 1). 这是因为,对于角量子数为 l 的格子,还存在另一个参数 m,叫磁量子数. 对于特定的角量子数 l,m 可以取 - l, - l + 1...0,...l - 1,l 等 2l + 1 个不同的值. 所以每个格子又可以根据不同的 m 细分成 2l+1 个小格子. 最后, 每一个小格子里面能装两个电子. 总共算下来,第 n 行刚好可以装 2n^2 个电子(见图 3 ).
到此为止, 每条轨道承载电子的数目已经解释清楚了, 但是应该如何把电子往格子里面放呢? 为了使电子总能量最小,对于氢原子(1 个核外电子), 显然电子应该放在 1S 格子里, 氦原子(2 个核外电子)可以把两个电子都放在 1S 格子里, 从而把 n=1 的轨道填满, 这就是第一周期的两个原子的电子分布. 对于锂原子(3 个核外电子)可以在氦原子的基础上往 2S 格子里放一个电子. 但奇怪的是, 填电子的顺序并不是从下到上从左到右, 而是如下图中的箭头所示, 即按照 1S, 2S, 2P, 3S, 3P, 4S, 3D, 4P, 5S\dots 的顺序来填上图的格子. 格子内的数字表示每格能装下的电子数, 即 2(2l + 1).
图 3:轨道的填充顺序
元素周期表的排序
要判断某个原子所在的周期, 就先根据原子序号找出上图中所有装有电子的格子, 其中 n 最大的格子就是该元素所在的周期. 例如 30 号元素, 可以按照上图绿色线条的顺序占满 1S, 2S, 2P, 3S, 3P, 4S, 3D (这些格子能容纳的总电子数刚好是 30). 其中 4S 的主量子数最大,n=4, 所以 30 号元素在第四周期. 按照这个规律, 把上图按照周期分类如下.
图 4:划分周期
1,元素周期表
(1)俄国化学家门捷列夫发现了元素周期表
(2)原子序数=核电荷数=质子数=核外电子数
(3)七个横行,即七个周期
同一横行的原子核外电子层数相同,最外层电子数从左到右依次(1——8)增多
(4)18个纵列,16个族,其中8,9,10三个纵列共同组成一个族
同一纵列的原子最外层电子数相同,由上到下电子层数(1——7)依次增大
(5)在周期表中,元素名称在中间位置,元素名称左上角数字代表原子序数,右上角是元素符号,下方是相对原子质量
2,微粒结构示意图
(1)原子结构示意图
体现了质子数,电子层及各层上的电子数,特别是最外层电子数
非金属元素的原子,最外层电子数大于4,易得电子,形成阴离子
金属元素的原子,最外层电子数小于4,易失电子,形成阳离子
稀有气体元素,最外层电子数等于8(氦是2),稳定结构
(2)离子结构示意图
体现质子数,电子层及各层上的电子数
质子数肯定不等于核外电子数

 更多
更多

 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底