氯的元素符号是Cl,原子量是35.5.氯气的分子式是Cl2分子量是71氯气是一种有毒的气体.在第一次世界大战快要结束的时候,德帝国主义为了作垂死的挣扎,曾把氯气用作军事毒气,在战场上施放,这当然不能挽救他最后的失败,一般大家都知道氯气是一种很厉害的毒气,但它究竟有些什么样的性质呢?下面我们先来研究氯气的性质。
氯气的物理性质氯气在普通状况下是一种黄绿色的气体.如果在一瓶贮盛氯气的玻璃瓶的后面,放一张白纸,这种黄绿的颜色就特别明显.“氯”就是因它的颜色而得名的,它的希腊原文就是“绿色”的意思。
氯气具有剧烈刺激性的气味.我们平常用的漂白粉能放出微量的氯气,打开贮放漂白粉的瓶盖,可以闻到这种刺激性的气昧.氯气有毒,它能刺激我们的鼻粘膜和喉头粘膜.吸入少量的氯气,就会引起咳嗽和胸部疼痛;吸入多量时,会窒息死亡①,在实验室里如果要闻氯气的气味,千万不能把鼻子凑到瓶口直接去闻,而要用手轻轻地在瓶口掮动,使仅有极微量的氯气飘近鼻孔(见第一册附录图附31)
氯气的分子量是71,根据气体克分子体积的定义(第册§8·11)可以算出,在标准状况下,1升氯气的重量应该是22.4=3.17克,这和实际测得的结果正相符合,我们已知1升空气在标准状况下的重量是1.29克,因此,氯气比空气重,3.17/1.29=2.5倍,因此,如果要把氯气它是同体积空气重量的暂时保存在容器里,应该把容器直放,并用厚纸板或玻璃片盖住容器的口,和第一册第三章里讲过保存二氧化碳气体的方法一样。
氯气在加压或冷却的情况下容易变成液体,在常温下只要加6个大气压的压强,或者在常压下冷却到-34°C时,氯气就会液化变成一种黄色油状的液体.把氯气液化可使体积大大减小,便于贮存和运输.平常我们常把液氯贮存在圆柱形钢筒(和贮存压缩氧气的钢筒相同,见第一册图2·9)里.把液氯继续冷却至-101℃C,就凝成黄色固体。
氯气在水里的溶解度,不仅比难溶的氢气、氧气要大得多,而且比溶解度不算太小的二氧化碳也还要大一些.在常温下,1体积的水大约能够溶解2.5体积的氯气,氯气的水溶液叫做氯水,有强烈的氯气的气味。
氯气的化学性质氯气的化学性质很活动,它能够跟氢气、所有的金属以及大部分的非金属直接化合,它还能够跟水、许多有机化合物发生反应.下面是一些实际例子,可以说明氯气的这种活动性质。
1.氯气跟金属的化合反应氯气能够跟所有的金属化合,许多金属能够在氯气里燃烧.例如把燃着的小块金属钠放进盛有氯气的集气瓶里,金属钠能继续燃烧,生成氯化钠,反应的化学方程式是:
2Na+Cl2= 2NaCl
 金属钠是一种柔软的银白色金属,可以用小刀切割.因为金属钠在空气里非常容易被氧化,跟水又能起剧烈反应,因此,平时都保存在煤油里.做这个实验的时候,先用镊子从煤油里夹出一小块金属钠,用滤纸吸干它表面的煤油,然后放在小块石棉布上,加热至钠开始燃烧,迅速连同石棉布一起放在燃烧匙里(这里所以要用石棉布,是为了防止燃烧匙本身也燃烧起来.因∈为燃烧匙一般是用铜制成的,在高温时,铜在氯气氯气里也会燃烧),插进盛氯气的集气瓶里金属钠在瓶里继续燃烧,发生明亮的黄色火鈉焰,并有浓厚的白烟产生,这就是氯化钠(NaCl)的微粒,钠燃烧完毕后,可以看到集气瓶的内壁和石棉布上都附着有白色氯化钠,除金属钠以外,铜、铁等金属也都能在氯气里燃烧,生成氯化铜、氯化铁等.它们反应的化学方程式是
金属钠是一种柔软的银白色金属,可以用小刀切割.因为金属钠在空气里非常容易被氧化,跟水又能起剧烈反应,因此,平时都保存在煤油里.做这个实验的时候,先用镊子从煤油里夹出一小块金属钠,用滤纸吸干它表面的煤油,然后放在小块石棉布上,加热至钠开始燃烧,迅速连同石棉布一起放在燃烧匙里(这里所以要用石棉布,是为了防止燃烧匙本身也燃烧起来.因∈为燃烧匙一般是用铜制成的,在高温时,铜在氯气氯气里也会燃烧),插进盛氯气的集气瓶里金属钠在瓶里继续燃烧,发生明亮的黄色火鈉焰,并有浓厚的白烟产生,这就是氯化钠(NaCl)的微粒,钠燃烧完毕后,可以看到集气瓶的内壁和石棉布上都附着有白色氯化钠,除金属钠以外,铜、铁等金属也都能在氯气里燃烧,生成氯化铜、氯化铁等.它们反应的化学方程式是
Cu+Cl2=Cucl2
2Fe+3C12=2FeC13
找一段废旧的电线,剥去电线的外皮,取出里面的细软铜丝,把一束这种细软铜丝,先在酒精灯上灼热到发红的程度,趁热迅速插入贮有氯气的集气瓶里,铜丝就会在瓶里燃烧起来,产生一股浓厚的棕黄色的烟,这就是氯化铜的微粒,铜丝燃烧完毕后,在集气瓶里注入少量的水.用玻璃片盖住瓶口,加以摇动,结果瓶中生成绿色的氯化铜溶液(图12)。
在做铁在氯气中燃烧的实验时,应先在盛氯气的集气瓶底铺一层细砂,这样可以防止燃着的铁屑落入瓶底时把集气瓶爆裂,先把少量的铁丝绒放在薄铁片上加热,当铁丝绒开始红热时,用手指轻弹铁片使撒入贮有氯气的集气瓶中,铁立刻就在氯气中燃烧起来,发出明亮的火花,同时生成褐色的氯化铁(图1·3)。
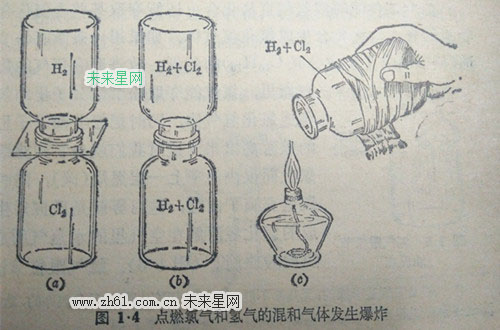
2.氯气跟氢气的化合反应氯气跟氢气在常温时化合非常缓慢,但在太阳光直接照射下,或点燃氯气和氢气的混和气体时,立即发生猛烈的爆炸,化合生成氯化氢气体,氯气跟氢气化合反应的化学方程式是:
H2+Cl2点燃或照光2HCI
先把氯气和氢气分别盛在两个集气瓶里,用玻璃片把瓶口盖好.把这两个集气瓶瓶口相对迭合在一起(图14(a),然后抽去两瓶间的玻璃片,把两集气瓶上下颠倒反复多次,使两瓶气体充分混和(图1·4(b))然后把两瓶分开,各用玻璃片盖好,并在瓶外用抹布裹住,然后取去玻璃片,把集气瓶口朝着酒精灯火焰(图1·4(c),瓶里的混和气体就会发生没有危险的爆炸.爆炸后立刻向集气瓶里注入5~10毫升的水,用玻璃片把瓶口盖好,并加摇动.再在瓶里滴入紫色石蕊试液四五滴,紫色石蕊立即变成红色(氯化氢的水溶液就是盐酸).做这个实验时,在点燃混和气体以前,一切操作都只能在微弱的光线下进行,千万不要让强光直接照射,否则在混和这两种气体时,可能发生爆炸的危险。
如果让氢气在氯气里燃烧,结果也同样能够相互化合成氯化氢气体(图1·5).在做这个实验时,必须注意点燃点以前,,定要过检纯的手续(第一册§2·12)。
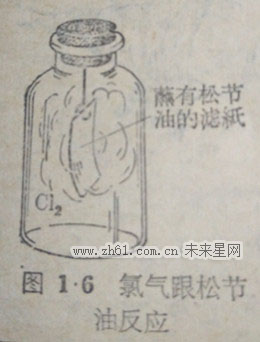
55氯气不仅能够跟氢气直接化合,还能夺取某些舍氢化合物里的氢,与之化合生成氯化氢气体.如果用一条蘸有松节油(松节油的主要成分是C10H10)的滤纸,放进贮有氯气的集气瓶里,氯气能夺取松节油分子里的氢生成氯化氢气体,同时把松节油分子里)孩的碳游离出来,这时我们就会看到滤纸条上面很CT快就蒙上一层黑烟(碳),同瓶时里充满了白雾,这白雾就是反应后生图1·6氯气眼松成的氯化氢溶解在空气里的水蒸气所成油反应的盐酸珠滴①(图1·6).氯气跟松节油的化学反应,可用下面的化学方程式表示:
C10H16+8Cl2= 16HCl+10C
3.氯气跟非金属的化合反应除了碳、氧、氮等少数几种非金属以外,氯气能跟大部分的非金属直接化合,例如磷能够在氯气里燃烧把少量红磷放在燃烧匙里,先用酒精灯的火焰加热到开始燃烧,迅速插入贮有氯气的集气瓶里,磷在氯气里继续燃烧,发出很淡的火焰反应结果生成三氯化磷和五氯化磷:
2P+3C12=2PCl3
三氯化磷
2P+5C12=2PCl5
五氯化磷
4.氯气眼水的反应氯气溶解于水,生成氯水.在氯水里有一部分氯分子缓慢地跟水分子反应,生成盐酸并放出氧气,氯气跟水的反应可简单地用下面的化学方程式表示:
2Cl2+2H2O=4HCl+O2↑
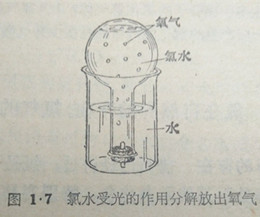
在日光照射下,这个反应进行较快,因此,氯水里除含有溶解的氯气外,还常含有盐酸.新制的氯水里含有盐酸的量很少,放置时间越长,所含盐酸也越多。
在圆底烧瓶里装满氯水,将烧瓶倒放在装有水的烧杯中,放在窗口有阳光的地方,经过几天以后,可以在烧瓶底部收集到一定量的氧气(图1·7).这氧气可以拿带有余烬的火柴梗来试验。

 更多
更多

 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底