化学键在本质上是电性的,原子在形成分子时,外层电子发生了重新分布(转移、共用、偏移等),从而产生了正、负电性间的强烈作用力。但这种电性作用的方式和程度有所不同,所以有可将化学键分为离子键、共价键和金属键等。
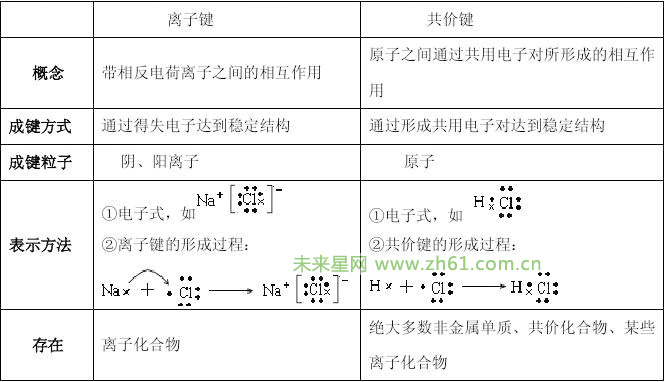
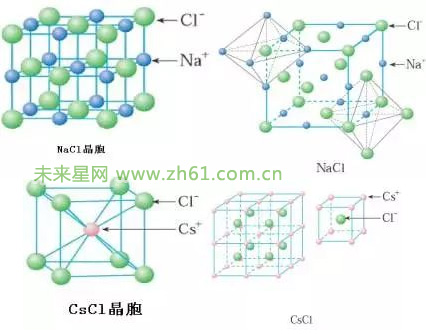
离子键是原子得失电子后生成的阴阳离子之间靠静电作用而形成的化学键。离子键的本质是静电作用。由于静电引力没有方向性,阴阳离子之见的作用可在任何方向上,离子键没有方向性。只有条件允许,阳离子周围可以尽可能多的吸引阴离子,反之亦然,离子键没有饱和性。不同的阴离子和阳离子的半径、电性不同,所形成的晶体空间点阵并不相同。
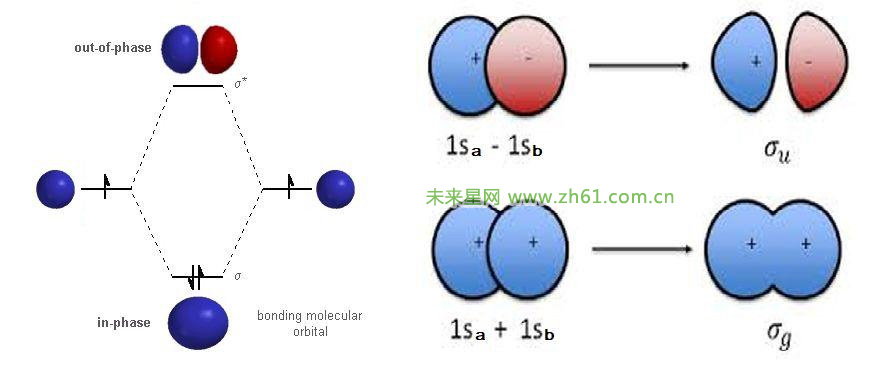
共价键是原子间通过共用电子对(电子云重叠)而形成的化学键。形成重叠电子云的电子在所有成键的原子周围运动。一个原子有几个未成对电子,便可以和几个自旋方向相反的电子配对成键,共价键饱和性的产生是由于电子云重叠(电子配对)时仍然遵循泡利不相容原理。电子云重叠只能在一定的方向上发生重叠,。共价键方向性的产生是由于形成共价键时,电子云重叠的区域越大,形成的共价键越稳定,所以,形成共价键时总是沿着电子云重叠程度最大的方向形成(这就是最大重叠原理)。共价键有饱和性和方向性。
近代实验和理论研究表明,离子键和共价键之间并没有绝对的界限。在一个具体的化学键中,化学键的离子性和共价性各占有一定的程度,因此有“键的离子性百分数”的概念,这完全是由电子对偏移的程度决定的。从理论上讲,共用电子对完全偏移形成的化学键就是离子键。绝大部分化合物中的原子之间是以共价键结合的,只有在很活泼的非金属离子(如卤素、氧等离子)与很活泼的金属离子(如碱金属离子)之间或电负性相差很大的金属与非金属之间才形成典型的离子键。即使最典型的离子化合物氟化铯(CsF)中的化学键也不是纯粹的离子键,键的离子性成分只占93 %,由于轨道的部分重叠使键的共价成分占7 %。
如果从第一性原理出发,那么就是只有库仑相互作用(量子力学里面一般只说相互作用,而且量子力学里面的力和经典力学里面的力也不太一样)。很多答主提到的交换作用本质上是量子多体效应在原子核势场下的一种表现。我们在处理实际的时候,大多数情况并不会直接去求解量子多体方程(实际上也几乎不可能做到精确求解),所以会将多体作用换成单电子方程来求解和构建物理图像,这时就会多出一堆由多体效应衍生出的乱七八糟的非线性相互作用,也就是交换和关联项。
离子键和共价键是否是一回事?这个看你从什么级别来理解,从电子层面来理解,是一回事,本质上都是电子在原子核势场下的分布问题。但如果从原子实的层面上去理解,那就是两个东西了。但实际上并不存在完全的离子键,只要是异核作用都有共价和离子成分,甚至对于同核体系只要两个原子所处的环境不一样(比如sp2-C和sp3-C),也有离子作用,只是哪个作用占主导。
两个电子排斥的问题看似简单,其实非常深刻,是我上面提到的量子多体效应的直接结果。如果不考虑复杂的推导过程,那么结论是两个电子其实是有静电排斥的,但是大多数情况静电排斥要小于交换作用。实际上在大多数情况下都是交换作用占主导,同时交换作用要求波函数满足轨道正交性和泡利不相容,在这种要求下,实际上电子间库仑排斥也会降到最低。也就是说交换作用和静电排斥很多时候具有相似的演化趋势。今天先写到这儿。之后有时间再补一下真正的dft计算中,是如何处理交换作用和电子间静电作用的。

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底