CO2的实验室制法
1、药品:大理石或石灰石、稀盐酸。2、原理:CaCO3+ 2HCl=CaCl2 + H2O + CO2↑(复分解反应)
3、发生装置要点:长颈漏斗下端管口要伸入液面下;导气管伸出橡皮塞少许。
收集装置要点:只能用向上排空气法收集。
◆排空气法收集气体时导管末端要伸入集气瓶底部。
◆不能用排水法收集的原因是因CO2能溶于水且能与水反应。
4、步骤:
(1) 连接装置,检查气密性;
教材P115图6-12发生装置气密性的检查方法:用弹簧夹夹住橡皮管,往长颈漏斗中加水;若长颈漏斗中形成水柱,且保持液面不下降,则不漏气。
(2) 装入药品,先加固体,再加液体。
(3) 收集气体.
5、检验CO2的存在:将气体通人澄清石灰水,若变浑浊,则证明是CO2。
检验CO2是否收集满:将燃着的木条放在集气瓶口,若熄灭,则集满。
实验室制取二氧化碳注意事项
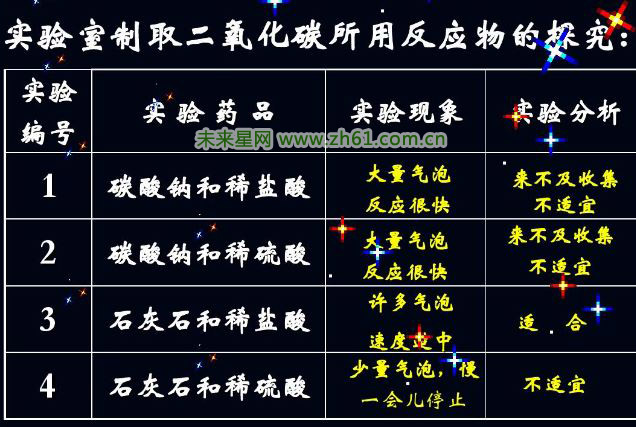
1、制取CO2不能用稀硫酸与大理石(或石灰石)反应,因为会发生反应:CaCO3+H2SO4==CaSO4+H2O+CO2↑,生成的CaSO4微溶于水,在溶液中析出后包裹在大理石(或石灰水)的外面,阻碍了反应的进一步发生。
2、制取CO2一般不选用浓盐酸,因其挥发出HCl气体,使收集到的CO2不纯。
3、能和稀盐酸反应生成CO2的物质还有Na2CO3、K2CO3等。
实验室制取二氧化碳装置
根据稀盐酸是液体,石灰石是块状固体及反应在常温条件下进行等情况,可以使用和实验室制H2相同的三套装置。
验满:用燃着的木条放在集气瓶口,木条熄灭说明已集满。
制取二氧化碳为什么不用稀硫酸
稀硫酸可以用来制取二氧化碳,但是实际上并不常用。这主要是因为它的优点和缺点之间的折衷。首先,稀硫酸有很好的分解作用,能够将二氧化碳溶液完全溶解,使溶液中的CO2含量最大化;其次,当稀硫酸水溶液与碳酸盐混合反应时,得到的二氧化碳都是抽滤溶液中的,其含量较低。而且,在溶液中溶解二氧化碳时,稀硫酸有可能产生有害的硫化物,这会对环境污染。
另一方面,乙醇乙酸乙酯(乙醇乙酸乙酯)也可以用来制取二氧化碳。乙醇乙酸乙酯的溶剂性良好,可以将二氧化碳完全溶解;而且,由于乙醇乙酸乙酯溶液中的二氧化碳含量分散,反应后二氧化碳的收率很高;同时,乙醇乙酸乙酯较为安全可靠,不会对环境造成污染。
总之,稀硫酸和乙醇乙酸乙酯都可以用来制取二氧化碳,但乙醇乙酸乙酯具有更多优势。由于它的溶剂性良好,反应收率高,而且不会对环境造成污染,所以乙醇乙酸乙酯经常被用于制取二氧化碳。
二氧化碳性质和用途
1、物理性质:无色,无味的气体,密度比空气大,能溶于水,高压低温下可得固体——干冰
2、化学性质:
1)一般情况下不能燃烧,也不支持燃烧,不能供给呼吸
2)与水反应生成碳酸:CO2+H2O=H2CO3 生成的碳酸能使紫色的石蕊试液变红,
H2CO3 = H2O+CO2↑ 碳酸不稳定,易分解
3)能使澄清的石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O ,本反应用于检验二氧化碳。
4)与灼热的碳反应:C+CO2=2CO
(吸热反应,既是化合反应又是氧化还原反应,CO2是氧化剂,C是还原剂)
3、用途:灭火(灭火器原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑)
既利用其物理性质,又利用其化学性质
干冰用于人工降雨、制冷剂
温室肥料
4、二氧化碳多环境的影响:过多排放引起温室效应。

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底