【知识梳理】
一、氧化还原反应1.定义:在反应过程中有元素的化合价升降的化学反应是氧化还原反应。
2.实质:反应过程中有电子的得失或共用电子对的偏移。
3.特征:化合价有升降。
4.氧化还原反应概念的发展
|
得氧和失氧观点 |
化合价升降观点 |
电子转移观点 | |
|
氧化反应 |
得氧的反应 |
化合价升高的反应 |
失去电子(或电子对偏离)的反应 |
|
还原反应 |
失氧的反应 |
化合价降低的反应 |
得到电子(或电子对偏向)的反应 |
|
氧化、还原关系 |
得氧失氧同时发生,得氧失氧总数相等 |
化合价升降同时发生,且升降总数相等 |
得失电子(或电子对偏离、偏向)同时发生,且得失(或偏离、偏向)总数相等 |
|
氧化还原反应 |
有氧得失的反应 |
有化合价升降的反应 |
有电子转移(电子得失或电子对偏移)的反应 |
|
评价 |
易于接受,但从形式上认识,具有片面性 |
比得氧失氧观点全面。但仅从表象上认识 |
从本质上认识氧化还原反应 |
|
举例 |
H2+CuO=(△)Cu+H2O | ||
二、氧化还原反应与四种基本反应类型
1.四种基本类型的反应
|
反应类型 |
举例 |
表示式 |
|
化合反应 |
CO2+H2O= H2CO3 |
A+B=AB |
|
分解反应 |
H2SO3=SO2+H2O |
AB=A+B |
|
置换反应 |
Fe+CuSO4= Cu+FeSO4 |
A+BC=AC+B |
|
复分解反应 |
CaCO3+2HCl==CaCl2+H2O+CO2↑ |
AB+CD=AD+CB |
2.氧化还原反应与四种基本类型反应的关系
①置换反应全部属于氧化还原反应。
②复分解反应全部属于非氧化还原反应。
③有单质参加的化合反应全部是氧化还原反应。
④有单质生成的分解反应全部是氧化还原反应。
⑤有单质参与的化学反应不一定是氧化还原反应,如3O2=2O3。
三、氧化还原反应的四对概念1.氧化剂与还原剂
氧化剂:得到电子(或电子对偏向、化合价降低)的物质。
还原剂:失去电子(或电子对偏离、化合价升高)的物质。氧化剂具有氧化性,还原剂具有还原性。
2.氧化反应与还原反应
氧化反应:失去电子(化合价升高)的反应。
还原反应:得到电子(化合价降低)的反应。
3.氧化产物与还原产物
氧化产物:还原剂在反应中失去电子后被氧化形成的生成物。
还原产物:氧化剂在反应中得到电子后被还原形成的生成物。
4.氧化性与还原性
氧化剂具有的得电子的性质称为氧化性;
还原剂具有的失电子的性质称为还原性。
总之记住六字口诀:升失氧,降得还!
解释:
四、氧化还原反应电子转移表示方法双线桥法:
(1)两条桥线从反应物指向生成物,且对准同种元素;
(2)要标明“得”“失”电子,且数目要相等;
(3)箭头不代表电子转移的方向。
单线桥法:
(1)一条桥线表示不同元素原子得失电子的情况;
(2)不需标明“得”“失”电子,只标明电子转移的数目;
(3)箭头表示电子转移的方向;
(4)单线桥箭头从还原剂指向氧化剂。
五、常见的氧化剂、还原剂常见的氧化剂(处于高价态的元素的单质或化合物):
(1)活泼的非金属单质(F2、O2、Cl2、Br2、I2、O3等)
(2)元素处于高价时的含氧酸(硝酸、浓硫酸)
(3)元素处于高价时的盐:(KClO3、KMnO4 、FeCl3)
(4)过氧化物(H2O2、Na2O2)
(5)其它(HClO)
常见的还原剂(处于低价态的元素的单质或化合物):
(1)活泼的金属单质:K、Na、Mg等;
(2)非金属单质:H2、C、Si等;
(3)低价态的化合物:CO、H2S、HI、Fe2+、NH3等。
六、氧化性、还原性强弱的比较(1)通过化学反应方程式比较:
在一个化学反应中,氧化剂的氧化性>氧化产物,还原剂的还原性>还原产物。
(2)依据金属活动性顺序
金属单质越活泼(还原性越强),对应阳离子的氧化性越弱。
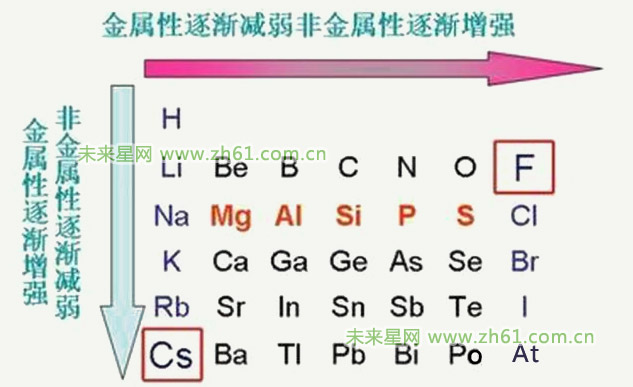
(3)依据元素周期律
金属单质的金属性越强,还原性越强,对应的金属阳离子的氧化性越弱;非金属单质的非金属性越强,氧化性越强,对应的阴离子的还原性越弱。
①对同一周期金属而言,从左到右,其金属活泼性依次减弱。如Na、Mg、A1金属性依次减弱,其还原性也依次减弱。
②对同主族的金属而言,从上到下,其金属活泼性依次增强。如Li、Na、K、Rb、Cs金属活泼性依次增强,其还原性也依次增强,对应的金属阳离子的氧化性减弱。
③对同主族的非金属而言,从上到下,其非金属活泼性依次减弱。如F、Cl、Br、I非金属活泼性依次减弱,其氧化性也依次减弱,对应的非金属阴离子的还原性增强。
(4)依据反应条件:
是否加热、有无催化剂、反应温度、反应物的浓度。
MnO2+4HCl(浓) =(△) MnCl2+C12↑+2H2O
2KMnO4+16HCl(浓)=2MnCl2+5C12↑+8H2O(常温)
前者比后者容易发生反应 (不需要加热),可判断氧化性:KMnO4>MnO2。
(5)依据相近似的反应:
氯气、硫与铜、铁的反应
如2Fe + Cl2=(△) FeCl3 , Fe + S=(△) FeS,根据铁被氧化程度的不同(Fe3+、Fe2+),可判断氧化性:C12>S。
又如,2Cu + Cl2=(点燃) CuCl2,Cu + S=(△) CuS,即氧化性: Cl2>S。
(6)同一种元素,一般价态越高其氧化性越强,但要注意特例。
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4<HClO3<HClO2< HClO。
注意:①物质的氧化性、还原性不是一成不变的。同一物质在不同的条件下,其氧化能力或还原能力会有所不同。如:氧化性:HNO3(浓)>HNO3(稀);Cu与浓H2SO4常温下不反应,加热条件下反应;KMnO4在酸性条件下的氧化性比在中性、碱性条件下强。②原子的氧化性一般都强于分子的氧化性。如:氧化性F>F2、Cl>Cl2、O>O2等。
(7)依据电化学原理。
①两种不同金属构成原电池的两极:
负极:金属电子流出,正极:金属电子流入
还原性:负极>正极
②根据电解池中溶液里阴、阳离子在两极放电顺序(在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强)来判断。
如:Cl-失去电子的能力强于OH-,还原性: Cl->OH-。
★常见氧化剂的相对强弱:
MnO4-(H+)>HClO>Cl2>浓硝酸>Br2>稀硝酸>Fe3+>I2
Fe3+>Cu2+>Fe2+
七、氧化还原反应的配平方法:
依据原子守恒、得失电子守恒、电荷守恒!
步骤:
(1)标出反应前后化合价发生变化的元素。
(2)列出化合价的变化,升高或降低。
(3)求化合价升降的最小公倍数,使化合价升高和降低的总数相等。
(4)先配变价元素,再用观察法配平气体元素原子的系数。
(5)检查原子、电荷是否守恒。
八、氧化还原反应方程式的计算
基本方法——得失电子守恒法:
对于氧化还原反应的计算,关键是氧化还原反应的实质——得失电子守恒,列出守恒关系求解,即n(氧化剂)×变价原子个数×化合价变化值=n(还原剂)×变价原子个数×化合价变化值。
【典型例题】
一、 氧化还原反应与基本反应类型之间的关系
1.下列类型的反应,一定发生电子转移的是()。
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【答案】C
【解析】A项,化合反应不一定是氧化还原反应,如NH3+HCl=NH4Cl,该反应中无电子转移;B项,分解反应不一定是氧化还原反应,如CaCO3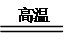 CaO+CO2↑,该反应中无电子转移;C项,置换反应一定是氧化还原反应,一定发生电子转移;D项,复分解反应都不是氧化还原反应,无电子转移。
CaO+CO2↑,该反应中无电子转移;C项,置换反应一定是氧化还原反应,一定发生电子转移;D项,复分解反应都不是氧化还原反应,无电子转移。
二、 氧化还原反应有关概念
2.下列变化中,一定需加还原剂才能实现的是( )。
A.CO2→CO32﹣
B.FeCl3→FeCl2
C.C→CO2
D.KMnO4→MnO
【答案】B
【解析】A.没有元素的化合价变化,故A不选;
B.Fe元素的化合价降低,需要加还原剂实现,故B选;
C.C元素的化合价升高,需要加氧化剂实现,故C不选;
D.Mn元素的化合价降低,但可发生自身氧化还原反应,不需要加还原剂,故D不选。
三、氧化还原反应中的电子转移
3.氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C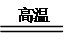 2A1N+3CO合成。下列叙述正确的是( )。
2A1N+3CO合成。下列叙述正确的是( )。
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41 g
【答案】B
【解析】该反应中 N2降价为氧化剂,C升价为还原剂,每生成1molAlN转移3mol电子,AlN中Al为+3价,N为-3价。D中摩尔质量的单位为g/mol。
四、 氧化性、还原性强弱的比较
4.已知在某温度发生如下反应:①C+CO2==2CO;②C+H2O==CO+H2;③CO+H2O==CO2+H2。由此可以判断,在该温度下,C、CO、H2的还原性强弱顺序是( )。
A.CO>C>H2
B.C>CO>H2
C.C>H2>CO
D.CO>H2>C
【答案】B
【解析】根据氧化还原反应中的还原性是:还原剂>还原产物。可知,还原性强弱顺序是:①中C>CO,②中C>H2,③中CO>H2,即C>CO>H2。
五、 氧化还原反应的配平
5.配平下列氧化还原反应方程式
(1) CuS+ HNO3(浓)— Cu(NO3)2+ H2SO4+ NO↑+ H2O
(2) KMnO4+ HCl(浓) — KCl+ MnCl2+ Cl2↑+ H2O
【答案】(1)3CuS+ 14HNO3(浓)= 3Cu(NO3)2+ 3H2SO4+ 8NO↑+ 4H2O
(2)2KMnO4+ 16HCl(浓) = 2KCl+ 2MnCl2+ 5Cl2↑+ 8H2O
六、氧化还原反应的有关计算
6.一定条件下硝酸铵分解的化学方程式为5NH4NO3![]() 2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子的物质的量之比为( )。
2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子的物质的量之比为( )。
A.5∶3 B.5∶4
C.1∶1 D.3∶5
【答案】A
【解析】反应中铵根离子中的氮元素化合价由-3价升至0价(失去电子被氧化),硝酸根离子中的氮元素化合价由+5价降至0价(得到电子被还原),根据氧化还原反应中得失电子守恒可知,被氧化与被还原的氮原子的物质的量之比为5∶3。
7.硫代硫酸钠可作为脱氯剂,已知25.0ml0.1mol/LNa2S2O3溶液恰好把224ml(标准状况)Cl2完全转化为Cl-离子,则S2O32-将转化成( )。
A.S2- B.S
C.SO32- D.SO42-
【答案】D
【解析】根据氧化还原反应的重要规律:得失电子数守恒,可知,反应中氯气所获得的电子的物质的量与硫代硫酸钠中硫失去的电子的物质的量相等。设硫的最终价态为x价。则有:
0.224L/22.4L•mol-1×2=0.025L×0.1mol/L×2×(x-2),解得x=6故选D。

 更多
更多




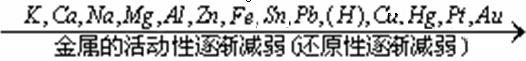
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底