氧化还原反应的计算
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
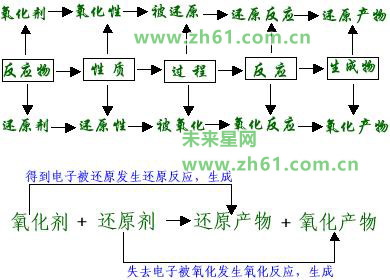
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
氧化还原反应的基本规律:
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。如
5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为:。
氧化还原反应有哪些配平口诀
升失氧,降得还,若是剂正相反
升失氧:化合价升高的是发生氧化反应
降得还:化合价降低的是发生还原反应
若是剂正相反:化合价升高的元素所对应的物质为还原剂,化合价降低的元素所对应的物质为氧化剂
2氧化还原反应配平有哪些技巧
常规配平方法
电子守恒法,也叫最小公倍数法,是万能方法,不管什么样的氧化还原反应,都适用。因为这是常规方法,老师们都会讲,这里我就不讲了。
特殊一点的方法
奇偶法:FeS2+O2=Fe2O3+SO2
我们很容易观察到只有Fe2O3中氧是奇数,那么它的系数肯定是偶数,假设是2,然后依据Fe守恒得FeS2的系数就是4,再根据S守恒得SO2的系数是8,最后根据O守恒得到O2的系数是11。配平完成!
如果出现某物质的系数是分数,可以同比例放大。
显然,这个方程式,如果用万能的电子守恒法来配平,是很麻烦的,因为它涉及到三种元素化合价的变化,而且氧在两种产物中都存在。
Na2O2+CO2=Na2CO3+O2也可以用奇偶法来快速配平。
待定系数法:配平方程式NH3+CH4+O2=HCN+H2O
设O2的系数是a,HCN的系数是b,则有bNH3+bCH4+aO2=bHCN+2aH2O
根据H守恒可以得到3b+4b=b+4a,化简得3b=2a,所以a=3,b=2,所以配平结果是:
NH3+2CH4+3O2=2HCN+6H2O
电荷守恒法:该方法大量用在离子方程式的配平和电极反应式的配平。这里就不举例子了。
平均化合价:特别适用于有机化学反应的配平,因为有机物中C元素的价态不易确定,用平均化合价就很方便。
0价法:Fe3C+HNO3=Fe(NO3)3+NO+H2O+CO2
Fe3C中Fe是几价?C是几价?干脆都设为0价!再根据电子守恒法来配平即可。
很特殊的整体法
1.(2017年高考北京卷)用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。写出该反应方程式。
解:先把反应物和生成物写出来,15NO+NH3+O2=15NNO+H2O
一部分N从+2价变到+1价,一部分N从-3价变到+1价,O从0价变到-2价,还有一部分O化合价不变。
电子守恒,怎么配?简单无从下手啊!
观察H元素,运用奇偶法思想,NH3的系数至少是2;观察15NNO的形式,运用整体法思想,15NO与NH3的系数肯定相同。所以有:215NO+2NH3+?O2=215NNO+?H2O
显然的H2O系数是3,O2的系数得配1.5,然后,所有系数乘以2,得到结果:
415NO+4NH3+3O2= 415NNO+6H2O
2.(2017年高考江苏卷)在制取工艺流程中,NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为——。
解:先写出框架Ag+NaClO+H2O=AgCl+NaOH+O2↑
银、氯、氧三种元素化合价发生变化,用电子守恒法既麻烦又出不来结果。
用整体法思想观察发现Ag和NaClO的系数必须相同,而根据H守恒知NaOH的系数至少是2(或2的倍数),那么就有2Ag+2NaClO+1H2O=2AgCl+2NaOH+?O2↑
显然O2的系数是0.5,然后,所有系数乘以2,得到结果:
4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底