原子能级是指原子系统能量量子化的形象化表示。按照量子力学理论,可计算出原子系统的能量是量子化的,能量取一系列分立值;能量值取决于一定的量子数,因此能级用一定的量子数标记。
原子能级是什么
1、原子轨道
原子轨道,是原子运动的轨道,还是原子外层电子的运动轨道?从书本中不难发现,原子轨道实际上就是电子运动轨迹分布情况的简化描述。那么为什么叫原子轨道,而不称为电子轨道呢?
首先我们可以形象的理解,是核外电子在与原子核的相互作用下绕核运动,电子的运动规律与轨道特点是由原子核作用所决定,相当于原子给这些电子地方,让这些电子在“原子的地盘”上运动,因此称其为原子轨道
2、原子轨道与能层关系
在原子世界,除了氢原子和特殊的离子可以为核外单电子结构外,其他的多电子原子的电子分布遵循着“构造原理”“泡利原理”“洪特规则”这三大规律。其实上面的三大分布规律,还是基于电子拥有的能量特点。
在化学中,根据电子能量的不同,将核外电子所在的轨道分成了不同的能层,并且对于diyi、二、三、四、五、六、七……能层,用“K,L,M,N,O,P……”来表示。由于电子的量子化特点,能层对于电子所拥有的能量分布的表示,还是基于一定概率范围中而言。
对于在同一个能层中的电子,其实际拥有的能量还是有一定波动的,因此我们就在大的能层范畴下,引入了能级概念。
3、能层与原子能级的关系
能层与能级的关系是什么?打个比方,能层是楼房的楼层,那么能级就是这些楼层中的楼梯。能级有时也被称为电子亚层,从名称上就不难发现,能级是被定义在能层的下一级,是不同能层下,电子所拥有能量分布更为细化的表示。有以下3个基本结论:
①轨道能是能层与能级的统称,单电子体系中,电子能量分布还是遵循能层-能级系统;
②在多电子原子中,电子根据三大规律,首先分布在不同的能层中,在不同的能层中,电子处在不同的能级上。
③在多电子原子中,轨道能依赖于特定的电子组态,轨道能随电子组态变化而变化。
原子能级排布特点
1、电子的运动情况
由力学原理可得电子的总能量E=Ek+Ep=½mv2-Ze2/4πε0r为了研究方便,将能量在极坐标系下表示,则有:
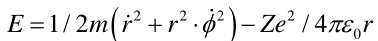
由于角动量PΦ=mr2Φ线动量Pr= mr·。由量子化条件:
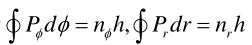
可得:
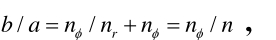
满足关系:
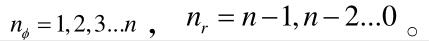
a、b分别为椭圆的长轴和短轴,只有当nΦ= n 时电子的运动轨道才是圆形,对于一个n值只有一个圆形轨道,n-1个椭圆轨道。可推得一个能量对应n个轨道,这是由于原子实的极化和轨道贯穿影响能量。
2、电子的自旋和轨道运动相互作用
但即便是主量子数n和角量子数nΦ(接下来用表示)都相同,电子运动轨道也并不唯yi确定。因为,电子不仅围绕原子核运动产生轨道角动量pl,同时又围绕自身ZX旋转产生自旋角动量ps也就具有了磁性。
那么具有磁性的电子(磁矩µs)在其围绕原子核运动形成的磁场B中附加能量为ΔE=-µsBcosθ,θ为µs和B的夹角。相应的角动量:
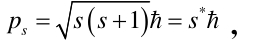
同理,轨道角动量:
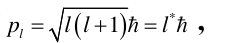
总的角动量:

通过实验的结果证明μs=eps/m,可求得附加能量。对于n和l确定时s取½,j的值等于l+½和l-½。于是附加能量有两个值,原来的单层能级劈裂成双层能级。可见,电子可能的运行轨道取决于电子的自旋和轨道运动。
原子能级跃迁
1、光子使原子能级跃迁的条件
玻尔的原子模型是以三条基本假设为基础,其中频率假设认为,原子从一个定态(设能量数值为En1)跃迁到另一定态(设能量数值为En2)时,它辐射或吸收一定频率的光子。辐射或吸收光子的能量数值不是任意的,而是由这两个定态的能级之差决定。即光子的频率v满足:
hv=En1-En2
值得指出:光子是一份一份的,光子的能量hv也是一份一份的。每一份光子能量都是不可“分割”的、原子所吸收的光子频率只有满足hv=En1-En2时,才能使原子吸收光子从基态或较低能级的激发态跃迁到较高能级的激发态。
这就是说,要用光子使原子受激发而发生跃迁,就必须使光子具有的能量hv等于发生跃迁的两个能级的能量差值;光子的能量大于或小于这个能量差值均不能使原子跃迁。
2、电子使原子能级跃迁的条件
夫克兰-赫兹实验结果指出:当电子速度增大到一定数值时,与原子的碰撞是非弹性的。电子把一部分能量传递给原子,使原子发生能级跃迁。当然,原子从电子所具有的能量中获取能量不是任意的,所能获取的能量值就等于发生跃迁的原子两个能级的能量之差值。
从力学角度分析。粒子间(如电子与原子、原子与原子等)的碰撞是要满足力学上的能量守恒和动量守恒原理的。因此二粒子间的碰撞一般不能把它们的全部动能转变为内部能量的,碰后仍会保留一部分动能以满足动量守恒关系。
但当电子与静止的原子碰撞时,由于电子质量很小。有可能差不多使电子的全部动能转变为原子的内能。所以从动能的利用来考虑,用电子碰撞来激发原子比用原子或分子来碰撞更有利。
需要指出:电子与光子不同,光子的能量是一份一份的。而电子的能量不是一份一份的。只要人射电子的能量大于或等于原子两个能级的能量之差值(即E=En1-En2)均可使原子发生能级跃迁。
3、电离——一种特殊的原子能级跃迁
所谓电离,是指电子从基态激发到脱离原子。即原子从基态(n=1)跃迁到Z高能级状态(n=∞),也就是电子从离核Z近的轨道跃迁到离核Z远的轨道(脱离原子核),电离过程所需要的能量称为电离电势能。
当原子吸收的能量等于电离电势能时,原子恰被电离;若吸收的能量大于电离电势能,原子也能被电离,且电离出的电子具有动能(其动能等于吸收的能量与电离电势能的差值);若吸收的能量小于电离电势能,则不会发生电离现象,将会跃迁到某一较高能级的激发态。

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底