在大量的光谱数据以及某些近似的理论计算的基础上,美国化学家鲍林(Pauling)提出了多原子的原子轨道近似能级图,图中的能级顺序是指电子按照能级从低到高在核外排布的顺序,即填入电子时各能级能量的相对高低。
中文名:原子轨道近似能级图
外文名:Atomic orbitalenergy level diagramapproximation
属 性:能级图
主 体:原子轨道
定义简介
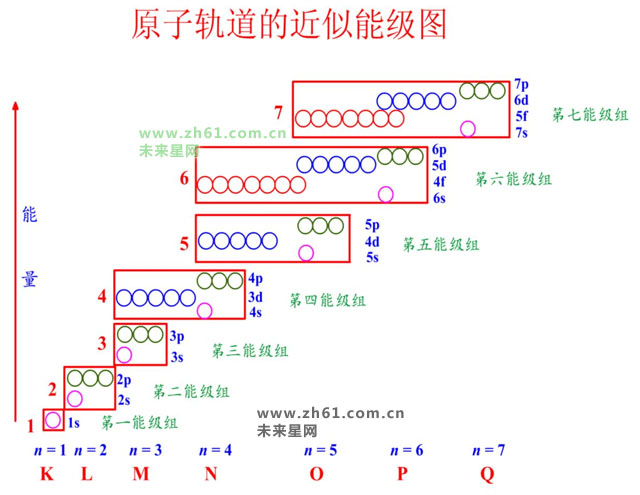
美国化学家Pauling经过计算,将原子轨道分为七个能级组。
第一组:1s
第二组:2s2p
第三组:3s3p
第四组:4s3d4p
第五组:5s4d5p
第六组:6s4f5d6p
第七组:7s5f6d7p
特点:
1、能级能量由低到高。
2、组与组之间能量差大,组内各轨道间能量差小,随n逐渐增大,这两种能量差逐渐减小。
3、第一能级组只有1s一个轨道,其余均有两个或两个以上,且以ns开始np结束。
4、能级组与元素周期相对应。
①近似能级图是按原子轨道的能量高低来排的,并不是按离核远近排的。严
格意义上只能叫“顺序图”,顺序是指轨道被填充的顺序或电子填入轨道的顺序,把能量的相近能级划成一组,称为能级组:
第一能级组 1s s轨道能容纳2个电子 第二能级组 2s,2p
第三能级组 3s,3p p轨道能容纳6个电子 第四能级组 4s,3d,4p
第五能级组 5s,4d,5p d轨道能容纳10电子 第六能级组 6s,4f,5d,6p 第七能级组 7s,5f,6d,7p f轨道能容纳14电子 第八能级组 8s,5g,6f,7d,8p
第九能级组 9s,6g,7f,8d,9p g轨道能容纳18电子
②主量子数n 相同,角量子数l越大能量越高,即发生“能级分裂”现象。例如:E4s< E4p < E4d < E4f 。
③当主量子数 n和角量子数 同时变动时,发生“能级交错”。 例如:E4s< E3d< E4p , E6s< E4f< E5d< E6p 。 可以按徐光宪的近似公式n+0.7 l计算能级。
“能级交错”和“能级分裂”现象都是由于“屏蔽效应”和“钻穿效应”引起的。
2、屏蔽效应和钻穿效应
⑴屏蔽效应:由于其它电子对某一电子的排斥作用而抵消了一部分核电荷,
使有效核电荷降低,消弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。屏蔽效应使原子轨道能量升高。
⑵钻穿效应:外层电子钻到内部空间而靠近原子核的现象,通常称为钻穿作用。由于电子的钻穿作用的不同而使它的能量发生变化的现象称为钻穿效应,钻穿效应使原子轨道能量降低。 二、核外电子的排布规律 1、最低能量原理
能量越低越稳定,这是自然界的一个普遍规律。多电子原子在基态时,核外电子总是尽可能分布到能量最低的轨道,这就称为能量最低原理。电子离原子核越近,能量越低。例如1s轨道的能量最低。
就是说,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入能量较高的轨道,以使原子处于能量最低的稳定状态。
原子轨道能量的高低为:
①当n相同,l不同时,轨道的能量次序s<p<d<f。如:E3S<E3P<E3d。 ②当n不同,l相同时,n愈大各相应的轨道能量愈高。如,E2S<E3S<E4S。 ③当n和l都不同时,轨道能量有交错现象即ns<(n-2)f<(n-1)d<np。 核外电子填充次序如下图所示。
2、泡利不相容原理
在同一原子中没有四个量子数完全相同的电子,或者说在同一原子中没有运动状态完全相同的电子。
例如,氦原子的1s轨道中有两个电子,描述其中一个原子中没有运动状态的一组量子数(n,l,m,ms)为1,0,0,+1/2,另一个电子的一组量子数必然是1,0,0,-1/2,即两个电子的其他状态相同但自旋方向相反。
根据鲍里不相容原理可以得出这样的结论,在每一个原子轨道中,最多只能容纳自旋方向相反的两个电子。于是,不难推算出各电子层最多容纳的电子数为2n个。 3、洪特规则
在等价轨道中,电子尽可能分占不同的轨道,且自旋方向相同。 实际上是最低能量原理的补充。因为两个电子同占一个轨道时,电子间的
2
排斥作用会使体系能量升高,只有分占等价轨道,才有利于降低体系的能量。 例如,碳原子核外有6个电子,除了有2个电子分布在1s轨道,2个电子分布在2s轨道外,另外2个电子不是占1个2p轨道,而是以自旋相同的方向分

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底