要点一、中和滴定的原理和方法。
1、定义:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的实验方法叫中和滴定法。
2、原理:在中和反应中使用一种已知物质的量浓度的酸(或碱)溶液与未知物质的量浓度的碱(或酸)溶液完全中和,测出二者所用的体积,根据反应化学方程式中酸、碱物质的量的比求出未知溶液的物质的量浓度。
3、关键:①准确测定参加反应的两种溶液的体积;②准确判断中和反应是否恰好完全反应。
4、指示剂的使用。
①用量不能太多,常用2~3滴,因指示剂本身也是弱酸或弱碱,若用量过多,会使中和滴定中需要的酸或碱的量增多或减少。
②指示剂的选择。
选择指示剂时,滴定终点前后溶液的颜色改变:颜色变化对比明显。
如强酸与强碱的中和滴定,到达终点时,pH变化范围很大,可用酚酞,也可用甲基橙;强酸滴定弱碱,恰好完全反应时,生成的盐水解使溶液呈酸性,故选择在酸性范围内变色的指示剂——甲基橙;强碱滴定弱酸,恰好完全反应时,生成的盐水解使溶液呈碱性,故选择在碱性范围内变色的指示剂——酚酞。
一般不用石蕊试液,原因是其溶液颜色变化对比不明显,且变色范围较大。
要点二、中和滴定操作。
1、中和滴定的仪器和试剂。
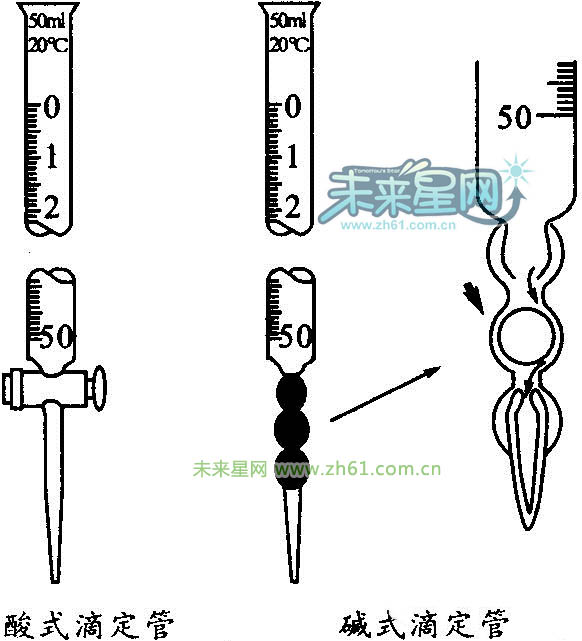
①仪器。酸式滴定管(不能盛放碱性溶液、水解呈碱性的盐溶液、氢氟酸)、碱式滴定管、铁架台、滴定管夹、烧杯、锥形瓶等。
②试剂。标准溶液、待测溶液、指示剂、蒸馏水。
2、准备过程。
①滴定管的使用:
a.检验酸式滴定管是否漏水(碱式滴定管同样检验)。
b.洗净滴定管后要用标准液润洗2~3次,并排除滴定管尖嘴处的气泡。
c.注入液体:分别将酸、碱反应液加入到酸式滴定管、碱式滴定管中,使液面位于滴定管刻度“0”以上2 mL~3 mL处,并将滴定管垂直固定在滴定管夹上。
d.调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液(如果酸式滴定管尖嘴部分有气泡,应快速放液以赶走气泡;除去碱式滴定管胶管中气泡的方法如图所示),并使液面处于某一刻度,准确读取读数并记录。
②锥形瓶:只能用蒸馏水洗涤,不能用待测液润洗。
要点诠释:(1)锥形瓶不能用待测液润洗,润洗后,瓶内壁会附着一定量的待测液。
(2)在滴定过程中,锥形瓶中液体用水冲稀,对实验结果无明显影响。
(3)滴定管在加入反应液之前要用所要盛装的反应液润洗,否则装入的液体会被稀释,影响结果。
3、实验步骤(以标准盐酸滴定待测NaOH溶液为例)。
①滴定管的检漏。
②洗涤:分别取酸式滴定管和碱式滴定管各一支(注意分析它们的结构),用清水洗净,再用标准酸液和待测碱液各润洗2~3次,润洗液必须从滴定管下端排出。
③装液:向滴定管中装入标准液,赶走气泡,使液面刻度在“0”刻度或“0”以下某一刻度处,记录读数,从碱式滴定管中放出一定体积碱液到洗净的锥形瓶中。
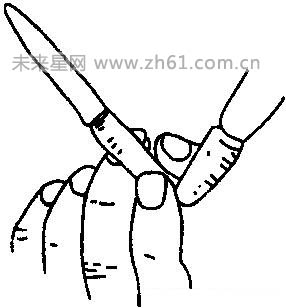
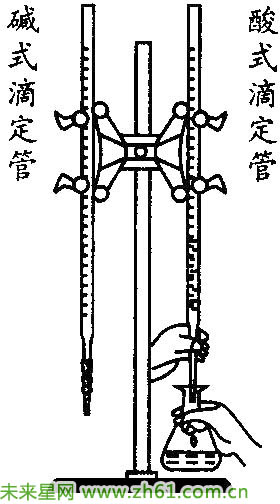
④滴定:往锥形瓶中加入2滴~3滴酚酞溶液,再向锥形瓶中滴加标准盐酸(先快后慢)。当滴定快到终点时应一滴一摇,若指示剂在半分钟内不变色,视为已到终点。滴定时应左手控制活塞,右手摇动锥形瓶(如图),两眼注视锥形瓶中颜色的变化。
⑤计算:定量测定时,只有多次重复实验才能排除偶然因素,减少实验误差。应依原理取两次或多次消耗标准溶液体积的平均值,求出![]() 。
。
要点三、中和滴定误差分析
若用标准溶液滴定待测液,消耗标准溶液多,则结果偏高;消耗标准溶液少,则结果偏低。分析误差时应设定c标、V待为不变值,将所有因素归结到V标上,凡使V标偏大的因素均使c待偏高,反之亦然。归纳起来,中和滴定的误差分析如下表所示(以用标准盐酸溶液滴定待测NaOH溶液为例):
|
步骤 |
操作 |
c(NaOH) |
|
洗涤 |
未用标准溶液润洗滴定管 |
偏高 |
|
锥形瓶用待测溶液润洗 |
偏高 | |
|
未用待测溶液润洗取待测液的滴定管 |
偏低 | |
|
锥形瓶洗净后瓶内还残留有蒸馏水 |
无影响 | |
|
滴定 |
滴定前滴定管尖嘴部分有气泡 |
偏高 |
|
滴定过程中振荡有液滴溅出 |
偏低 | |
|
滴定时有几滴标准溶液附在锥形瓶瓶壁上 |
偏高 | |
|
读数 |
滴定前仰视读数或滴定后俯视读数 |
偏低 |
|
滴定前俯视读数或滴定后仰视读数 |
偏高 |
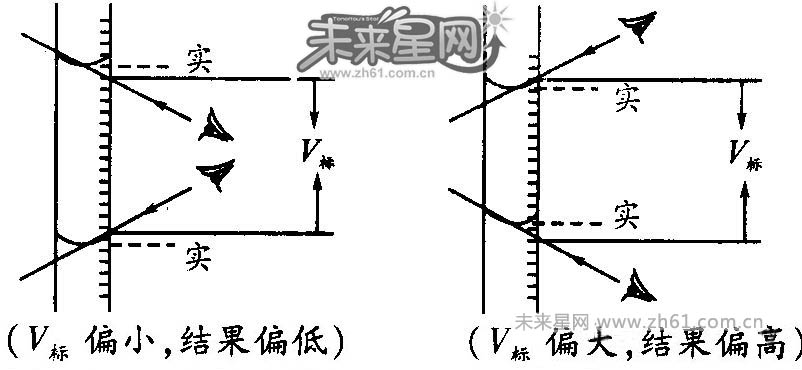
要点诠释:读数误差可以用画图的形式来理解和记忆。如开始仰视读数,滴定完毕俯视读数,结果偏低;开始俯视读数,滴定完毕仰视读数,结果偏高,如图。
读数时使眼睛和液面凹面最低点及刻度线保持水平,读取与液面凹面相切处的数据。
1.酸与碱完全中和时( )。
A.酸与碱的物质的量一定相等
B.酸所能提供的H+与碱所能提供的OH-的物质的量相等
C.酸与碱的质量相等
D.溶液呈中性
2.室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是( )
A.0.1 mol·L―1的盐酸和0.1 mol·L―1的氢氧化钠溶液
B.0.1 mol·L―1的盐酸和0.1 mol·L―1的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=10的氨水
3.下图中,曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
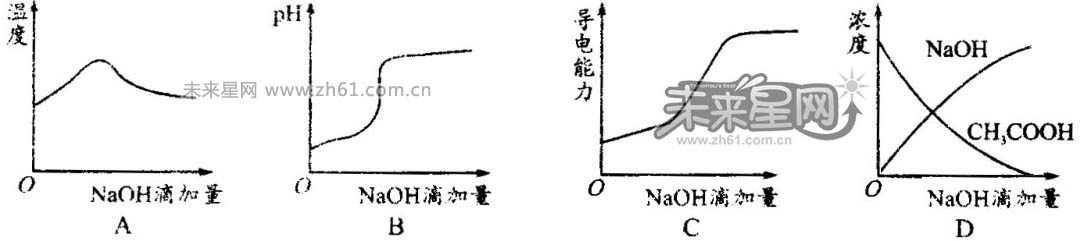
4.将氢氧化钠稀溶液滴加到醋酸稀溶液中,如图示意混合溶液有关量或性质的变化趋势,其中错误的是( )D
5.某研究小组为测定食用白醋中醋酸的含量进行如下操作,其中正确的是( )
A.用碱式滴定管量取一定体积的待测白醋放入锥形瓶中
B.称取4.0 g NaOH固体放入1000 mL容量瓶中,然后加水至刻度,配成1.00 mol·L―1 NaOH标准溶液
C.用NaOH溶液滴定白醋,使用酚酞作指示剂,溶液颜色恰好由无色变为浅红色,且半分钟内不褪色时,为滴定终点
D.滴定时眼睛要注意着滴定管内NaOH溶液的液面变化,防止滴定过量
6.对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10―12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
7.已知常温、常压下,饱和CO2的水溶液的pH=3.9,则可推断用标准的盐酸溶液滴定NaHCO3水溶液时,适宜选用的指示剂及滴定终点时颜色变化的情况是( )
A、石蕊,由蓝变红 B、甲基橙,由橙变黄
C、酚酞,红色褪去 D、甲基橙,由黄变橙
8.充满HCl的烧瓶做完喷泉实验后得到的稀盐酸,用标准碳酸钠溶液滴定这种盐酸测定它的准确浓度,请你回答下列问题:
(1)用标准Na2CO3溶液滴定这种盐酸时,Na2CO3溶液应装在________式滴定管中,若用甲基橙作指示剂,达到滴定终点时,溶液从________色变为________色。
(2)现配制三种浓度的标准Na2CO3溶液,你认为最合适的是下列第________种。
①2.500 mol·L-1 ②0.25 mol·L-1 ③0.025 mol·L-1
(3)配制Na2CO3标准溶液的主要操作步骤为:计算→称量→溶解→________→洗涤(并将洗涤液移入容量瓶)→________→________→将配制好的溶液倒入试剂瓶中,贴上标签。
(4)下列实验操作能引起误差,对中和滴定结果的影响为:
㈠.来自滴定管操作产生的误差:
a滴定管用蒸馏水洗后,未用标准液润洗__________
b滴定管未用待测液润洗 __________
㈡.来自锥形瓶操作产生的误差:
a锥形瓶用蒸馏水洗后又用待测液洗_______
b锥形瓶未洗净,残留有与待测液中溶质反应的少量物质_________
㈢.读数带来的误差:
a用滴定管量取待测液
①先俯视后仰视________ ②先仰视后俯视_________
b标准液
①先俯视后仰视________ ②先仰视后俯视_________
8.(1)碱 红 橙 (2)③ (3)转移 定容 摇匀
【解析】第(2)问中充满HCl烧瓶做喷泉实验所得盐酸的物质的量浓度为:![]() 与之相匹配的为③(误差小);
与之相匹配的为③(误差小);
(4)若C1:标准液浓度;V1:标准液体积,V2:待测液体积。误差分析时,关键是看所分析因素使哪个值发生了何种变化。
㈠.如滴定管用蒸馏水洗后,未用标准液润洗,肯定使C1减小,但计算时仍带入的原值,所以使测定结果偏高。
a滴定管用蒸馏水洗后,未用标准液润洗 偏高
b滴定管未用待测定液润洗 偏低
㈡.来自锥形瓶操作产生的误差:
a锥形瓶用蒸馏水洗后又用待测液洗。 偏高
b锥形瓶未洗净,残留有与待测液中溶质反应的少量物质。 偏低
㈢.读数带来的误差:
a用滴定管量取待测液
①先俯视后仰视 偏低 ②先仰视后俯视 偏高
b标准液
① 先俯视后仰视 偏高 ②先仰视后俯视 偏低
②

 更多
更多

 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底