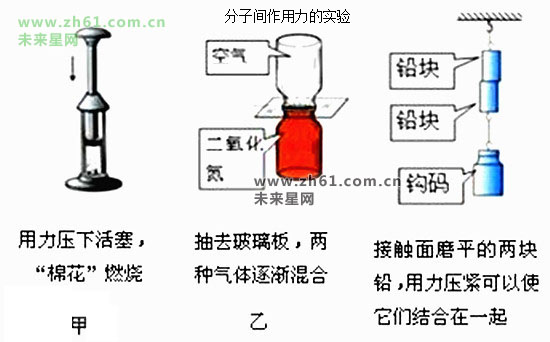
分子间作用力,又称范德瓦尔斯力(van der Waals force)。分子间作用力(范德瓦尔斯力)有三个来源:极性分子的永久偶极矩之间的相互作用。一个极性分子使另一个分子极化,产生诱导偶极矩并相互吸引。分子中电子的运动产生瞬时偶极矩,它使邻近分子瞬时极化,后者又反过来增强原来分子的瞬时偶极矩;这种相互耦合产生静电吸引作用,这三种力的贡献不同,通常第三种作用的贡献最大。
分子间作用力只存在于分子(molecule)与分子之间或惰性气体(noble gas)原子(atom)间的作用力,又称范德华力(van der waals),具有加和性,属于次级键。
氢键(hydrogen bond)、弱范德华力、疏水作用力、芳环堆积作用、卤键都属于次级键(又称分子间弱相互作用)。
中文名:分子间作用力
外文名:intermolecular force
别 名:范德华力,范氏力
作用对象:分子之间 高分子化合物内官能团
一般分类:范德华力、氢键、其他非共价键
来源分类:色散力,取向力,诱导力,其他
归 属:化学,力,分子间力
范德华力指分子间作用力即存在于中性分子或原子之间的一种弱碱性的电性吸引力。某物质的范德华力越大,则它的熔点、沸点就越高。对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增强。

 更多
更多
 返回顶部
返回顶部 刷新页面
刷新页面 下到页底
下到页底